
Struktur und Funktion von Zell-Zell Kontakten
Grundlagen
Zell-Zell Kontakte im Pankreas
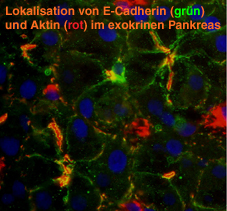
Zell-Zell-Kontakte im exokrinen Pankreas, welches zu mehr als 90% aus epithelialen Azinuszellen und Gangzellen besteht, sind entscheidend an der Differenzierung und Funktion des Organs beteiligt. Die Bildung und Aufrechterhaltung von Zell-Kontakten bestimmt einerseits, ob und wie Pankreaszellen mit einander kommunizieren, und andererseits zu welchen anatomischen Strukturen sie sich organisieren und differenzieren. Wir konnten zeigen, daß eine supra-physiologische Stimulation des Pankreas mit Cholezystokinin- oder Acetylcholin-Analoga in vivo zu einer Dissoziation von Adherens Junctions im Pankreas führt (1), und daß diese Dissoziation mit einer schweren Störung der Exozytose (2,3), der Endozytose (4) und des polarisierten intrazellulären Transportes einher geht (5). Darüber hinaus fanden wir, daß die Auflösung von Adherens Junctions zwischen den Azinuszellen des Pankreas von einer Dissoziation des Cadherin/Catenin Komplexes begleitet wird, und die Bestandteile dieses Komplexes ins Cytosol der Azinuszelle internalisiert werden (1). Da dieser Prozeß innerhalb von 48 h in vivo vollständig reversibel ist, bietet sich das Modell der kontrollierten Dissoziation und Restitution von Adherens Junctions für zellbiologische Untersuchungen der Regulation von Zell-Zell-Kontakten im intakten Organ an.
Der überwiegende Teil der interzellulären Verbindungen zwischen Azinuszellen des Pankreas gehört zur Klasse der Adherens Junctions. An Adherens Junctions werden Zell-Kontakte in erster Linie durch homophile, Ca++-abhängige Interaktion des Transmembran-Glykoproteins E-Cadherin vermittelt (6). Der cytosolische Anteil von E-Cadherin bindet an Proteine der Catenin-Familie. b-Catenin und g-Catenin interagieren direkt mit E-Cadherin und vermitteln über die Bindung an a-Catenin. die Verankerung des Cadherin/Catenin Komplexes an den Mikrofilamenten des Aktin-Zytoskeletts (7). Das 1992 entdeckte p120-Catenin, ein Substrat der src-Tyrosin Kinase, bindet ebenfalls an den intrazellulären Teil von E-Cadherin, nicht aber an a-Catenin oder b-Catenin (8). Seine Funktion besteht offenbar in einer Stabilisierung der Zell Kontakte (9).
Die Tatsache, daß eine genetische Deletion von E-Cadherin bei entsprechenden knock-out Mäusen zur frühen Letalität in der Embryonalentwicklung führt (10,11), unterstreicht die Bedeutung des Cadherin/Catenin Komplexes für die Gewebedifferenzierung und Morphogenese (12). Auch bei der Differenzierung epithelialer Tumorzellen spielen Zell-Adhäsionsproteine eine bedeutende Rolle (13). Es wird angenommen, daß die Funktion von E-Cadherin und der Catenine darin besteht, daß sie die Ablösung maligner Zellen aus dem Tumorverband und damit die Gewebeinvasion und Fernmetastasierung des Tumors verhindern können. Eine Bedeutung für die maligne Tumorprogression beim Menschen wurde für Mechanismen berichtet, die die Funktion des Cadherin/Catenin Komplexes stören, wie z. B. somatische Mutationen, reduzierte Expression durch CpG-Methylierung oder Tyrosin-Phosphorylierung von b-Catenin (14,15,16,17).
Neben einer Rolle bei der Bildung von Zell-Zell Kontakten wurde für Proteine der Cadherin/Catenin Familie auch eine Funktion als intrazelluläre Signalüberträger berichtet.
Diese Funktion liegt im Bereich verschiedener intrazellulärer Signalkaskaden die am Zellwachstum beteiligt sind. Für b-Catenin wurde beispielsweise eine Beteiligung in der Wnt-Signalkaskade berichtet. Sezerniertes Wnt-Glykoprotein hemmt die Serin-Threonin Phosphorylierung von cytosolischem b-Catenin. Während das Produkt des APC-Tumor-Suppressor-Gens die Phosophorylierung und Degradation von b-Catenin vermittelt (18). Entweder als Antwort auf das Wnt-Signal, oder bei Abwesenheit von APC wird unphosphoryliertes b-Catenin in den Zellkern importiert und kann dort eine Reihe wachstumsinduzierender Transkriptionsfaktoren aktivieren (19,20). E-Cadherin reguliert indirekt die proliferative Funktion von b-Catenin. Es kontrolliert durch die Bindung von b-Catenin an Zell Kontakten die freie Menge von b-Catenin im Zytosol, die für die Signalübertragung zur Verfügung steht (21). Auch für andere Zell Adhäsionproteine, wie zum Beispiel p120-Catenin, wurde ein Kernimport beschrieben. Als Signalsequenz für eine nukleäre Translokation dient ein hochkonservierter Bereich zwischen der Armadillo Repeat 6 und 7 Domäne.
Die Phosphorylierung an Tyrosinresten hat für die Regulation des Cadherin/Catenin Komplexes große Bedeutung. Die Aktivierung verschiedener Tyrosinkinasen wie zum Beispiel die des EGF-Rezeptors, oder eine Überexpression von v-src resultieren nicht nur in einer Tyrosin-Phosphorylierung von b- und g-Catenin, sondern auch in einer Dissoziation von Zell-Zell-Kontakten in unterschiedlichen in vitro Systemen (14,22). Andererseits führt auch die Hemmung von Protein-Tyrosin-Phosphatasen zur Dissoziation von Zell-Zell-Kontakten in epithelialen MDCK-Zellen (23). Die meisten Studien legen nahe, daß die Aufrechterhaltung von intakten Adherens Junctions die Aktivität von Protein-Tyrosin-Phosphatasen voraussetzt, um den Cadherin/Catenin Komplex in seinem aktiven, unphosphorylierten Zustand zu halten. Für eine Reihe von Protein-Tyrosin-Phosphatasen wurde bereits gezeigt, daß sie in Zellkultur- und Überexpressionssystemen entweder an Zell-Kontakten lokalisiert sind (24,25), mit dem Cadherin/Catenin Komplex assoziieren können (26,27), oder sogar die Proteine des Cadherin/Catenin Komplexes als Substrat dephosphorylieren (26,28,29,30). Welche Relevanz diese in vitro Beobachtungen für die Verhältnisse in einem komplexen, epithelialen Organ wie dem exokrinen Pankreas haben, ist weitgehend unbekannt. Ziel unserer laufenden Untersuchungen ist deshalb die Charakterisierung der Funktion spezifischer Protein-Tyrosin-Phosphatasen bei der Bildung von Zell-Zell-Kontakten des Pankreas in vivo oder in Differenzierungsmodellen des Pankreas in vitro.
Literaturangaben
- Lerch, M.M., M.P. Lutz, H. Weidenbach, F. Müller-Pillasch, T.M. Gress, J. Leser and G. Adler (1997). Dissociation and reassembley of Adherens Junctions during early secretagogue-induced pancreatitis. Gastroenterology 113,1355-1366.
- Lerch, M.M., A.K. Saluja, R. Dawra, M. Saluja and M.L. Steer (1993). The effect of chloroquine administration on two experimental models of acute pancreatitis. Gastroenterology 104,1768-1779.
- Lerch, M.M., A. Saluja, M. Rünzi, R. Dawra, M. Saluja and M.L. Steer (1993). Pancreatic duct obstruction triggers acute necrotizing pancreatitis in the opossum. Gastroenterology 104,853-861.
- Lerch, M.M., A.K. Saluja, M. Rünzi, R. Dawra and M.L. Steer (1995). Luminal endocytosis and intracellular targeting by acinar cells during early biliary pancreatitis in the opossum. J. Clin. Invest. 95,2222-2231.
- Jungermann, J., M.M. Lerch, H. Weidenbach, M.P. Lutz, B. Krüger and G. Adler (1995). Disassembly of the rat pancreatic acinar cell cytoskeleton during supramaximal secretagogue stimulation. Am. J. Physiol. 268,G328-G338.
- Nose, A., Nagafuchi, A., Takeichi, M. (1988) Expressed recombinant cadherins mediate cell sorting in model systems. Cell 54:993-1001
- Aberle, H., Schwartz, H., Kemler, R. (1996) Cadherin-catenin complex: protein interactions and their implications for cadherin function. J. Cell Biochem. 61:514-523
- Reynolds, A.B., Herbert, L., Cleveland, J.L., Berg, S.T., Gaut,J.R. (1992) p120, a novel substrate of protein tyrosine kinase receptors and of p60v-src, is related to the cadherin-binding factors b-catenin, plakoglobin and armadillo. Oncogene 7: 2439-2445
- Yap, A.S., Niessen, C.M., Gumbiner, B.M. (1997) The juxtamembrane region of the cadherin cytoplasmatic tail supports lateral clustering, adhesive strengthening, and interaction with p120ctn. J. Cell Biol. 14: 779-789.
- Larue, L., Ohsugi, M., Hirchenhain, J., Kemler, R. (1994) E-Cadherin null mutant embryos fail to form a trophoectoderm epithelium. Proc. Natl. Acad. Sci.. USA 91,:8263-8267
- Riethmacher, D., Brinkmann, V., Birchmeier, C. (1995) A targeted mutation in the mouse E-Cadherin gene results in defective preimplantation development. Proc. Natl. Acad. Sci. USA 92,:855-859
- Takeichi, M. (1995) Morphogenetic roles of classic cadherins. Curr. Op. Cell Biol. 7:619-627
- Vleminck, K., Vakaet, L., Mareel, M., Fiers, W., van Roy, F. (1991) Genetic manipulation of E-Cadherin expression by epithelial tumor cells reveal an invasion suppressor role. Cell 66:107-119
- Behrens, J., Vakaet, L., Friis, R., Winterhager, E., Van Roy, F., Mareel, M.M., Birchmeier, W. (1993) Loss of epithelial morphotype and gain of invasiveness correlates with tyrosine phosphorylation of the E-Cadherin/ß-catenin complex in cells transformed with a temperature-sensitive v-src gene. J. Cell Biol. 120:757-766
- Hirohashi, S. (1998) Inactivation of the E-Cadherin mediated cell adhesion system in human cancers. Am. J. Pathol. 153:333-339
- Perl, A.K., Wilgenbus, P., Dahl, U., Semb, H., Christofori, G. (1998) A causal role for E-Cadherin in the transition from adenoma to carcinoma. Nature 392:190-193
- Guilford, P., Hopkins, J., Harraway, J., McLeod, M., McLeod, N., Harawira, P., Taite, H., Scoular, R., Miller, A., Reeve, A.E. (1998) E-Cadherin germline mutations in familial gastric cancer. Nature 392:402-405
- Barth, A.I.M., Näthke, I.S., Nelson, W.J. (1997) Cadherins, catenins and APC protein: interplay between cytosceletal complexes and signaling pathways. Curr. Op. Cell Biol. 9:683-690
- Behrens, J., von Kries, J.P., Kuhl, M., Bruhn, L., Wedlich, D., Grosschedl, R., Birchmeier, W. (1996) Functional interaction of ß-catenin with the transcription factor LEF-1. Nature 382:638-642
- Korinek, V., Barker, N., Morin, P.J., van Wichern, D., de Weger, R., Kinzler, K.W., Vogelstein, B., Clevers, H. (1997) Constitutive transcriptional activation by a ß-catenin-Tcf complex in APC-/- colon carcinoma. Science 275:1784-1787
- Fagotto, F., Funayama, N., Gluck, U., Gumbiner, B.M. (1996) Binding to cadherins antagonizes the signaling activity of ß-catenin during axis formation in Xenopus. J. Cell. Biol. 132:1105-1114
- Hazan, R.B., Norton, L. (1998) The epidermal growth factor receptor modulates the interaction of E-Cadherin with the actin cytosceleton. J. Biol. Chem. 273:9078-9084
- Collares-Buzato, C.B., Jepson, M.A., Simmons, N.L., Hirst, B.H. (1998) Increased tyrosine phosphorylation causes redistribution of adherens junction and tight junction proteins and perturbs paracellular barrier function in MDCK epithelia. Eur. J. Cell Biol. 76:85-92
- Wang, H., Z. Lian, M.M. Lerch, Z. Chen, W. Xie, and A. Ullrich (1996). Characterization of PCP-2, a novel receptor protein tyrosine phosphatase of the MAM domain family. Oncogene 12,2555-2562.
- Aicher, B., M.M. Lerch, T. Müller, J. Schilling and A. Ullrich (1997). Cellular redistribution of protein tyrosine phosphatases LAR and PTPs by inducible proteolytic processing. J. Cell Biol. 12,2555-2562
- Fuchs, M., T. Müller, M.M. Lerch, and A. Ullrich (1996). Association of human protein-tyrosine phosphatase k with members of the armadillo family. J. Biol. Chem. 271,16712-16719.
- Brady-Kalnay, S., Mourton, T., Nixon, J.P., Pietz, G.E., Kinch, M., Chen, H., Brackenburry, R., Rimm, D.L., DelVecchio, R.L., Tonks, N.K. (1998) Dynamic interaction of PTPµ with multiple Cadherins in vivo. J. Cell. Biol. 141:287-296
- Kypta, R.M., Su, H., Reichardt, L.F. (1996). Association between a transmembrane protein tyrosine phosphatase and the cadherin-catenin complex. J. Cell. Biol. 134:1519-1529
- Keilhack, H., Hellmann, U., von Hengel, J., van Roy, F., Godovac-Zimmermann, J. and Böhmer, F.D. (2000). The Protein-tyrosine Phosphatase SHP-1 binds to and dephosphorylates p120 Catenin. J. Biol. Chem. 275:26376-26384
- Zondag, G.C.M.,Reynolds, A.B. and Moolenaar, W.H. (2000). Receptor Protein-tyrosine Phosphatase RPTPµ binds to and dephosphorylates the Catenin p120. J. Biol. Chem. 275:11264-11269
Autor:
Prof. Dr. med. Markus M. Lerch
Klinik und Poliklinik für Innere Medizin A
Universitätsmedizin Greifswald
Ferdinand-Sauerbruch-Str.
D-17475 Greifswald
Telefon: +49 (0)3834 86-7230
Fax: +49 (0)3834 86-7234
E-Mail: gastro@uni-greifswald.de