
Gutartige und bösartige Neubildungen des Pankreas
Grundlagen
 Benigne Tumoren der Bauchspeicheldrüse sind sehr selten und hierbei sind die entzündlichen Pseudotumoren wesendlich häufiger als regelrechte benigne Neubildungen des Pankreas (z.B. des seröse Zystadenom bei Frauen im höheren Lebensalter). Das Pankreaskarzinom ist dagegen die vierthäufigste Ursache krebsbedingter Todesfälle in der westlichen Welt und das Malignom mit der bei weitem schlechtesten Prognose von allen Neubildungen des Gastrointestinaltraktes. Fünf Jahre nach Stellung der Diagnose leben im Mittel noch vier von 1000 Patienten und die mediane Lebenserwartung beträgt 4-6 Monate. Bei nur 10-20% der Patienten ist die Ausdehnung der Tumorerkrankung bei Stellung der Diagnose noch so begrenzt, daß eine kurative chirurgische Resektion versucht werden kann. Selbst in diesen prognostisch günstigen Fällen liegt die fünf-Jahres-Überlebensrate bei nur 3-24%. Alle Versuche, diese Krankheit mit zytostatischen Chemotherapeutika oder mit einer Bestrahlungstherapie anzugehen, haben weitgehend enttäuscht und keine signifikante Lebensverlängerung erbracht. Eine allgemein etablierte Chemotherapie für das Pankreaskarzinom gibt es heute deshalb nicht und alle neueren und aggressiveren Kombinationschemata müssen sich an der bisher effektivsten Einzelsubstanz, dem 5-Fluouracil, mit seiner bescheidenen Ansprechrate von ca. 20% der Tumoren und einer Lebensverlängerung von eher Wochen als Monaten messen. Aus diesem Grund kann die adjuvante oder palliative Chemotherapie von Patienten mit Pankreaskarzinom nur im Rahmen kontrollierter und randomisierter Studien empfohlen werden. Auch klar definierte Präkanzerosen oder eine molekulargenetisch charakerisierte Entwicklung von prämalignen Veränderungen zum invasiven Karzinom, wie sie für das Colonkarzinom vorliegen, sind beim Pankreaskarzinom noch nicht bekannt. Die häufigsten im Pankreaskarzinom nachgewiesenen molekulargenetischen Veränderungen betreffen das Protooncogen K-ras und den Tumorsuppressor p53. Bei 90% der Pankreaskarzinome finden sich Mutationen im K-ras Gen (60% alleine in Codon 12) die wahrscheinlich dazu führen daß dieser, unter physiologischen Umständen von der Zelle regulierbare Wachstumsfaktor, einen konstituitiven, also nicht mehr regulierten Wachstumsreiz darstellt. Eine Gegenregulation ungerichteter Wachstumsreize übernehmen häufig sogenannte Tumorsuppressoren. Eines dieser Tumorsuppressorgene, p53, ist im Pankreaskarzinom beinahe ebenso häufig mutiert (und damit funktionsuntüchtig) wie das Protooncogen K-ras. Nach heutiger Auffassung wird angenommen, daß die K-ras Mutationen einen frühen Entwicklungsschritt in Richtung auf eine maligne Transformation darstellen während die p53 Mutationen zur Persistenz des malignen Phänotyps beitragen. Inzwischen ist es möglich die entsprechenden molekulargenetischen Veränderungen von K-ras und p53 nicht nur im Gewebe, sondern beispielsweise auch im endoskopisch gewonnenen Pankreassekret nachzuweisen. Sollten sich diese zur Zeit noch sehr aufwendigen und teuren Methoden als sensitives und spezifisches Verfahren bei der Diagnose des Pankreaskarzinoms bewähren und dann auch noch auf leichter zugängliches Probenmaterial wie Stuhl oder Blut ausweiten lassen, dann stünde erstmals ein diagnostisches Screeningverfahren für das Pankreaskarzinom zur Verfügung. Die Rolle weiterer, im Tumor differentiell deletierter Gene (z.B. DPC, deleted in pancreatic carcinoma) wird zur Zeit noch untersucht.
Benigne Tumoren der Bauchspeicheldrüse sind sehr selten und hierbei sind die entzündlichen Pseudotumoren wesendlich häufiger als regelrechte benigne Neubildungen des Pankreas (z.B. des seröse Zystadenom bei Frauen im höheren Lebensalter). Das Pankreaskarzinom ist dagegen die vierthäufigste Ursache krebsbedingter Todesfälle in der westlichen Welt und das Malignom mit der bei weitem schlechtesten Prognose von allen Neubildungen des Gastrointestinaltraktes. Fünf Jahre nach Stellung der Diagnose leben im Mittel noch vier von 1000 Patienten und die mediane Lebenserwartung beträgt 4-6 Monate. Bei nur 10-20% der Patienten ist die Ausdehnung der Tumorerkrankung bei Stellung der Diagnose noch so begrenzt, daß eine kurative chirurgische Resektion versucht werden kann. Selbst in diesen prognostisch günstigen Fällen liegt die fünf-Jahres-Überlebensrate bei nur 3-24%. Alle Versuche, diese Krankheit mit zytostatischen Chemotherapeutika oder mit einer Bestrahlungstherapie anzugehen, haben weitgehend enttäuscht und keine signifikante Lebensverlängerung erbracht. Eine allgemein etablierte Chemotherapie für das Pankreaskarzinom gibt es heute deshalb nicht und alle neueren und aggressiveren Kombinationschemata müssen sich an der bisher effektivsten Einzelsubstanz, dem 5-Fluouracil, mit seiner bescheidenen Ansprechrate von ca. 20% der Tumoren und einer Lebensverlängerung von eher Wochen als Monaten messen. Aus diesem Grund kann die adjuvante oder palliative Chemotherapie von Patienten mit Pankreaskarzinom nur im Rahmen kontrollierter und randomisierter Studien empfohlen werden. Auch klar definierte Präkanzerosen oder eine molekulargenetisch charakerisierte Entwicklung von prämalignen Veränderungen zum invasiven Karzinom, wie sie für das Colonkarzinom vorliegen, sind beim Pankreaskarzinom noch nicht bekannt. Die häufigsten im Pankreaskarzinom nachgewiesenen molekulargenetischen Veränderungen betreffen das Protooncogen K-ras und den Tumorsuppressor p53. Bei 90% der Pankreaskarzinome finden sich Mutationen im K-ras Gen (60% alleine in Codon 12) die wahrscheinlich dazu führen daß dieser, unter physiologischen Umständen von der Zelle regulierbare Wachstumsfaktor, einen konstituitiven, also nicht mehr regulierten Wachstumsreiz darstellt. Eine Gegenregulation ungerichteter Wachstumsreize übernehmen häufig sogenannte Tumorsuppressoren. Eines dieser Tumorsuppressorgene, p53, ist im Pankreaskarzinom beinahe ebenso häufig mutiert (und damit funktionsuntüchtig) wie das Protooncogen K-ras. Nach heutiger Auffassung wird angenommen, daß die K-ras Mutationen einen frühen Entwicklungsschritt in Richtung auf eine maligne Transformation darstellen während die p53 Mutationen zur Persistenz des malignen Phänotyps beitragen. Inzwischen ist es möglich die entsprechenden molekulargenetischen Veränderungen von K-ras und p53 nicht nur im Gewebe, sondern beispielsweise auch im endoskopisch gewonnenen Pankreassekret nachzuweisen. Sollten sich diese zur Zeit noch sehr aufwendigen und teuren Methoden als sensitives und spezifisches Verfahren bei der Diagnose des Pankreaskarzinoms bewähren und dann auch noch auf leichter zugängliches Probenmaterial wie Stuhl oder Blut ausweiten lassen, dann stünde erstmals ein diagnostisches Screeningverfahren für das Pankreaskarzinom zur Verfügung. Die Rolle weiterer, im Tumor differentiell deletierter Gene (z.B. DPC, deleted in pancreatic carcinoma) wird zur Zeit noch untersucht.
Zum heutigen Zeitpunkt ist weder mit bildgebenden Verfahren, noch mit sogenannten Tumormarkern eine wirkliche Frühdiagnose des Pankreaskarzinoms möglich. Bei der ganz überwiegenden Zahl der Patienten, die an diesem Tumor erkrankt sind, wird die Diagnose zu einem Zeitpunkt gestellt an dem nicht nur keine kurative Therapie, sondern nicht einmal eine lebensverlängernde Behandlung mehr möglich ist. Im Vordergrund der klinischen Betreuung dieser Patienten steht deshalb die Verbesserung ihrer Lebensqualität und die Palliation ihrer Symptome.
Klinik des Pankreaskarzinoms
Nachdem die Inzidenz des Pankreaskarzinoms bis zu den achziger Jahren weltweit zugenommen hatte, scheint sie seit den neunziger Jahren stabil zu bleiben. Der Altersgipfel der Erkrankung liegt zwischen dem 50. und 70. Lebensjahr, und nach neueren Statistiken sind Männer nur noch geringradig häufiger betroffen als Frauen. Eine echte Präkanzerose des Pankreaskarzinoms ist, vermutlich wegen der diagnostischen Unzugänglichkeit des Organs im Retroperitoneum, bis heute nicht gesichert worden. Etwa 15% der Pankreaskarzinome wurden in einer skandinavischen Studie erst als Zufallsbefund bei der postmortalen Sektion entdeckt. Es wurden in der Vergangenheit sowohl eine familiäre Prädisposition für das Pankreaskarzinom nachgewiesen als auch verschiedene exogene Faktoren, die sein Entstehen begünstigen, gesichert. An erster Stelle stehen dabei der Alkohol- und Nikotinabusus sowie die chronische Pankreatitis. In welchem Maße jeder einzelne dieser drei Faktoren ins Gewicht fällt, läßt sich bis heute nicht mit Sicherheit sagen, da sie extrem häufig vergesellschaftet sind und viele klinische Studien sie nicht gegeneinander korrigiert haben. Neuere Untersuchungen weisen darauf hin, daß auch eine abgelaufene akute Pankreatitis das statistische Risiko, an einem Pankreaskarzinom zu erkranken, nahezu sechsfach erhöht. Die früher vertretene Hypothese, daß ein hoher Kaffeekonsum das Risiko für die Entwicklung des Pankreaskarzinoms steigert, wird heute wieder in Zweifel gezogen. Viel eher scheint dagegen der gesteigerte Durst der Patienten ein Frühsymptom dieses Tumors zu sein. Die meisten Patienten stellen sich wegen Gewichtsverlust, Inappetenz, Schmerzen oder Ikterus erstmals beim Arzt vor. Der Gewichtsverlust hat sich meist sehr rasch entwickelt und beträgt nicht selten 10% des Köpergewichtes. Je ausgeprägter der Gewichtsverlust bei Diagnosestellung, desto schlechter scheinen die Aussichten für die Resektatbilität des Tumors und die Prognose des Patienten zu sein. Das variabelste klinische Zeichen beim Pankreaskarzinom ist der Verschlußikterus (Tabelle). Es tritt sehr frühzeitig bei einer Tumorlokalisation im Bereich der Papille auf (und bestimmt dadurch die gute Prognose der Papillenkarzinome), ist sehr häufig bei einer Tumorlokalisation im Pankreaskopfbereich (70-80% der Pankreaskarzinome), und kann bei Karzinomen im Corpus und Schwanz des Organs völlig fehlen. Bei 70-90% der Patienten sind abdominelle, oft in den Rücken ausstrahlende Schmerzen das erste Symptom eines Pankreaskarzinoms. Sie treten häufiger auf, wenn der Tumor im Corpus oder Schwanz des Organs lokalisiert ist und haben meist einen dumpfen und bohrenden Charakter. Der Ursache der Schmerzen ist nicht nur eine lokale Verdrängung benachbarter Strukturen, sondern häufig eine Penetration des Tumors ins Retroperitoneum und eine lokale Infiltration entlang von Nervenscheiden. Etwa 60-80% der Patienten haben eine gestörte Glukosetoleranz. Zum einen wird heute angenommen, daß ein vorbestehender, langjähriger Diabetes mellitus (mehr als 5 Jahre) das Risiko für die Erkrankung an einem Pankreaskarzinom etwa verdoppelt. Auf der anderen Seite wissen wir aus neueren Untersuchungen, daß es sich bei der gestörten Glukosetoleranz oft um ein Frühsymptom des maligen Tumors handelt. Hierbei wird wahrscheinlich vom Tumor selbst ein diabetogener Faktor (möglicherweise spielt diese Rolle das islet amyloid polypeptid) produziert, der die Glukosetoleranz verschlechtert. Hierfür spricht die Beobachtung, daß sich die diabetische Stoffwechsellage vieler Patienten nach Resektion des Pankreaskarzinoms verbessert.
Diagnostik und Differentialdiagnose
Laboruntersuchungen
Die laborchemischen Veränderungen beim Pankreaskarzinom sind ganz überwiegend unspezifisch. In 10-15 % der Patienten entspricht nicht nur die klinische Symptomatik, sondern auch die Laborkonstellation einer akuten Pankreatitis. Ursache hierfür ist meist die Obstruktion des Pankreasganges durch die bösartige Neubildung. Bei den meisten Patienten liegen zum Zeitpunkt der Diagnose Zeichen einer Cholestase (die alkalische Phosphatase ist bei 82% erhöht) oder eines Verschlußikterus vor. Zu diesen Veränderungen kommt es meist durch eine Kompression oder Infiltration des extrahepatischen Ductus choledochus bei einer Lokalisation des Karzinoms im Bereich der Papille oder des Pankreaskopfes. Gelegentlich wird der Verschlußikterus so spät diagnostiziert, daß Patienten mit bereits vorliegender Cholangitis eingewiesen werden. Beim Versuch, ein vermutetes, impaktiertes Gallenwegskonkrement endoskopisch zu entfernen, wird dann gelegentlich erst das Pankreaskarzinom diagnostiziert. Erhöhte Serumspiegel von einer Reihe von sogenannten Tumormarkern, meist handelt es sich um sekretorische Glyoproteine von Tumoren des Gastrointestinaltraktes, werden beim Pankreaskarzinom gefunden. Eine große Zahl klinischer Untersuchungen liegen zum Beispiel für CEA, CA 19-9, CA 50, und CA 72-4 vor. Die Ergebnisse dieser Studien besagen, daß sich bedauerlicherweise keiner dieser Tumormarker für die Frühdiagnose oder gar als Screeningparameter beim Pankreaskarzinom eignet. Zum einen steigen die Serumspiegel erst bei größeren Pankreaskarzinomen signifikant an, zum anderen sind auch die chronische Pankreatitis oder die Cholestase alleine mit erhöhten Serumspiegeln vergesellschaftet. Eine sichere Differenzierung zwischen einer entzündlichen und einer malignen Raumforderung im Pankreas ist deshalb anhand von Tumormarkern, insbesondere bei Vorliegen einer Cholestase, nicht möglich. Liegt dagegen ein histologisch gesichertes Pankreaskarzinom vor, dann kann davon ausgegangen werden, daß sich erhöhte CA 19-9 Serumspiegel nach einer vollständigen Resektion innerhalb von zwei Wochen normalisieren und ihr Wiederanstieg als frühzeitiger Hinweis auf eine Rezidiv gewertet werden muß. Somit sollte die Bestimmung von Tumormarkerspiegeln im Serum als Verlaufsparameter für gesicherte Karzinome und nicht zu deren Diagnostik eingesetzt werden.
Bildgebende Verfahren
Sonographie
An erster Stelle der bildgebenden Verfahren steht, aus den gleichen Gründen, die bei der Diagnostik der Pankreatitis aufgeführt wurden, die Sonographie. Die Sensitivität des Ultraschalls beim Nachweis von Tumoren im Pankreas liegt zwischen 80-90%. Eine Differenzierung zwischen entzündlichen und malignen Raumforderungen gelingt dagegen sehr viel seltener. Während sich Raumforderungen zwischen 1 und 1,5 cm noch relativ sicher nachweisen lassen sinkt die Sensititvität bei kleineren Läsionen drastisch. Bei der Aufdeckung einer Peritonealkarzinose oder einer Infiltration in Gefäßwände ist die Sonographie anderen diagnostischen Verfahren weit unterlegen. Sowohl der Ultraschall, als auch die anderen bildgebenden Verfahren (vielleicht mit Ausnahme der Endosonographie) schätzen die Größenausdehnung des Pankreaskarzinoms meist nicht korrekt ein. Dies hat zum einen technische Gründe, wie zum Beispiel die Reflektion des Ultraschalls an Grenzflächen, die keineswegs mit anatomischen Grenzstrukturen übereinstimmen müssen, und hat andererseits tumorbiologische Gründe. Einige Pankreaskarzinome sind von signifikanten Mengen entzündeten Gewebes oder von einem desmoplakischen Bindegewebesaum umgeben, die sich auch im CT nur schwer vom Tumor selbst abgrenzen lassen. Obwohl Abweichungen der Größenabschätzung in beide Richtungen vorkommen wird die Ausdehnung eines Pankreaskarzinoms in den bildgebenden Verfahren eher unter- als überschätzt. Durch die Möglichkeit, mittels Punktionsschallköpfen Gewebe für die histologische Untersuchung zu gewinnen, läßt sich vor allem die Spezifität der Sonographie auf 90-100% steigern. Vor allem, wenn anhand der bildgebenden Verfahren von einem nicht mehr lokal resektablen Befund ausgegangen werden kann, ist eine histologische Klassifizierung von Raumforderungen im Pankreas unerläßlich, weil sich Tumoren neuroendokrinen Ursprungs und seltenere Karzinomtypen (Tabelle) im Bezug auf ihre Prognose und ihr Ansprechen auf Zytostatika sehr anders verhalten können als die zahlenmäßig weit überwiegenden duktalen Adenokarzinome. Liegt ein resektabler Pankreastumor vor, dann muß das sehr geringe Risiko einer Aussaat von Tumorzellen ins Peritoneum oder den Biopsiekanal gegen den präoperativen Informationsgewinn abgewogen werden. Auch die Differenzierung zystischer Raumforderungen im Pankreas kann oft nur aufgrund einer Feinnadelpunktion erfolgen. Bei der Unterscheidung zwischen entzündlichen Pseudozysten bei chronischer Pankreatitis, serösen Zystadenomen, muzinösen Zystadenomen und Zystadenokarzinomen ist nicht nur eine histologische und zytologische Untersuchung des Punktats hilfreich, sondern auch eine Untersuchung des Zysteninhalts auf Pankreasenzyme und die Tumormarker CEA und CA 19-9. Mit Hilfe einer zusätzlichen Duplexsonographie läßt sich gelegentlich eine Tumorinvasion der großen Gefäße sichern. Falls diese vorliegt, muß davon ausgegangen werden, daß das Malignom nicht mehr kurativ operabel ist.
Endosonographie
Die Untersuchung mit hochfrequenten Ultraschallköpfen, die via Endoskopie direkt der Magen- und Duodenalwand angelegt werden, ist heute bei Pankreaskarzinomen von weniger als 1,5 cm das sensitivste Verfahren. Dies gilt nach neueren Untersuchungen nicht nur für die neuroendokrinen Tumoren der Bauchspeicheldrüse und schließt auch Tumoren im Corpus und Schwanz des Pankreas ein. Auch eine Beurteilung der großen peripankreatischen Gefäße im Hinblick auf eine Tumorinvasion scheint mittels Endosonographie oft zu gelingen. Inwieweit die sichere Abgrenzung zwischen entzündlichen und malignen Veränderungen, vor allem bei bekanntem Vorliegen einer chronischen Pankreatitis, mittels Endosonographie möglich ist, müssen weitere klinische Studien zeigen.
Computertomographie
Das CT ist heute immer noch der Goldstandard bei der primären und präoperativen Diagnostik des Pankreaskarzinoms. Vor allem die vorläufige Festlegung des Tumorstadiums (Tabelle 14) vor einem operativen Eingriff basiert heute noch weitgehend auf dem Ergebniss des CT. Zwar steigt auch bei diesem bildgebenden Verfahren die Zahl falsch negativer Ergebnisse bei Tumoren unter 1 cm Durchmesser deutlich an, aber die zusätzliche Beurteilbarkeit der abdominellen Gefäße nach i.v. Kontrast und die deutlich größere Sensititivität bei der Entdeckung einer Peritonealkarzinose machen das CT dem Ultraschall überlegen. Durch die neueren Entwicklungen des Spiral- und High Resolution CT wird sich die Sensitivität und vielleicht auch die Spezifität dieser Methode noch verbessern lassen. Ähnlich wie bei der Diagnostik der Pankreatitis bedeutet die Verwendung eines i.v. Kontrastmittelbolus, wegen der häufigen Kontrastanreicherung auch kleiner Tumoren, einen deutlichen Informationsgewinn. Die Rolle der Kernspintomographie ist, wie bereits bei der Diagnostik der Pankreatitis diskutiert, im Fluß. Die heute gebräuchlichen schnellen und atmungsgetriggerten Sequenzen lassen erwarten, daß das MRT dem CT bei der Diagnostik von Pankreastumoren in naher Zukunft überlegen sein könnte. Die Differenzierung zwischen entzündlichen und malignen Raumforderungen im Pankreas gelingt zwar mittels CT und MRT etwas häufiger als mit der Sonographie alleine, die Spezifität dieser beiden Methoden ist aber, vor allem bei Vorliegen einer chronischen Pankreatitis, immer noch unzureichend.
Positronen-Emissions-Tomographie
Bei der Positronen-Emissions-Tomographie wird die Aufnahme radioaktiv markierter Stoffwechselmetaboliten im Schnittbild dargestellt. Eine Reihe neuerer Untersuchungen dieses Verfahrens weisen darauf hin, daß sich bei Verwendung von Fluor-2-Deoxy-D-Glukose das Pankreaskarzinom wegen seines höheren Glukoseumsatzes mit einer Spezifität von 88% von der chronischen Pankreatitis abgrenzen läßt. Zwar ergibt das PET des Pankreas nur wenig Information über die genaue Lokalisation und Ausdehnung des Karzinoms aber durch die Möglichkeit der Differenzierung zwischen entzündlichen und neoplastischen Raumforderungen könnte sich für diese Methode in Zukunft ein Stellenwert in der Pankreasdiagnostik ergeben.
Angiographie
Vor Einführung der Computertomographie und des Ultraschall war die Angiographie der abdominellen und peripankreatischen Gefäße eine unerläßliche Methode zur Beurteilung der Resektabilität des Pankreaskarzinoms (Abb. 10). Heute ist ihre Rolle weniger entscheidend, aber viele Chirurgen wünschen eine angiographische Darstellung zur besseren anatomischen Beurteilung des Operationssitus und zur Planung der Operationsstrategie.
ERCP
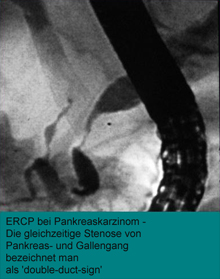 Die ERCP ist eine sehr treffsichere Methode bei der Diagnostik des Pankreaskarzinoms. Dies liegt vor allem an der Tatsache, daß Karzinome des Pankreas in 80-90% der Fälle zu Einengungen des Pankreasgangsystems führen. Ein weiterer Vorteil ist die Möglichkeit, Pankreassekret für die eingangs erwähnten molekulargenetischen Untersuchungen und für die Zytologie zu gewinnen. Zum anderen läßt sich nicht nur das Pankreasgangsystem sondern auch die Gallengänge beurteilen und, bei Vorliegen einer Cholestase, auch während des gleichen Untersuchungsganges eine palliative Ableitung durch Einlage eines Kunststoffstents schaffen. Bei Vorliegen das klassischen double-duct-sign, also einer umschriebenen Stenose sowohl im Ductus choledochus als auch im Ductus Wirsungianus, liegt mit über 90 prozentiger Wahrscheinlichkeit ein Pankreaskarzinom vor.
Die ERCP ist eine sehr treffsichere Methode bei der Diagnostik des Pankreaskarzinoms. Dies liegt vor allem an der Tatsache, daß Karzinome des Pankreas in 80-90% der Fälle zu Einengungen des Pankreasgangsystems führen. Ein weiterer Vorteil ist die Möglichkeit, Pankreassekret für die eingangs erwähnten molekulargenetischen Untersuchungen und für die Zytologie zu gewinnen. Zum anderen läßt sich nicht nur das Pankreasgangsystem sondern auch die Gallengänge beurteilen und, bei Vorliegen einer Cholestase, auch während des gleichen Untersuchungsganges eine palliative Ableitung durch Einlage eines Kunststoffstents schaffen. Bei Vorliegen das klassischen double-duct-sign, also einer umschriebenen Stenose sowohl im Ductus choledochus als auch im Ductus Wirsungianus, liegt mit über 90 prozentiger Wahrscheinlichkeit ein Pankreaskarzinom vor.
Therapie
Alle therapeutischen Anstrengungen haben in den letzten 20 Jahren keine statistisch bedeutsame Lebensverlängerung von Patienten mit Pankreaskarzinom bewirkt, und die Chance eines Patienten mit dieser Erkrankung, nach fünf Jahren noch am Leben zu sein, ist 1:250. An erster Stelle der Behandlungmethoden steht nach wie vor die Chirurgie. Eine Operation mit kurativem Ansatz kommt nur für 10-20 % der Patienten in Frage. Als Zeichen für eine Inoperabilität gelten die Peritonealkarzinose, Fernmetastasen und die häufige Beteiligung der pankreasnahen Gefäße (Vena portae, Vena lienalis, Vena mesenterica superior, Arteria mesenterica superior). Einige Chirurgen resezieren heute gelegentlich trotz einer Gefäßwandbeteiligungen von weniger als 2 cm und überbrücken das fehlende Gefäßstück durch eine Prothese. Die pankreasresezierenden Eingriffe waren früher mit einer extrem hohen Letalität belastet. Diese liegt heute in den meisten Zentren um oder unter 5%. Dieser günstige Prozentsatz ist immer noch so hoch, daß sich palliative Operationen bei der sehr kurzen Lebenserwartung von Patienten mit Pankreaskarzinom (4-6 Monate) nicht etabliert haben. In der Regel wird eine partielle Duodenopankreatektomie (Whipple), eine pyloruserhaltende Duodenopankreatektomie oder, allerdings verbunden mit einer deutlich höheren Letalität, eine totale Duodenopankreatektomie durchgeführt. Die fünf-Jahres-Überlebensrate nach einem solchen, in kurativer Absicht durchgeführten Eingriff liegt zwischen 3 und 25%. Diese Variabilität korreliert einerseits mit der Tumorgröße, hängt aber möglicherwiese auch damit zusammen, wie streng die Indikation zur Operation gestellt wurde. Die enttäuschenden Überlebensraten nach kurativer Resektion des Pankreaskarzinoms deuten darauf hin, daß dieser Tumor bereits sehr früh von einer lokalen und wahrscheinlich auch einer systemischen Mikrometastasierung begleitet ist. Aus diesem Grund wurden zusätzlich zur Operation verschiedene adjuvante Behandlungsmethoden untersucht. Die bisher besten Ergebnisse hat die adjuvante Kombination von 5-Fluourazil mit einer lokalen Bestrahlung gezeigt (2 Jahres Überlebensrate ca 45% im Vergleich zu 18% bei alleiniger Operation). Allerdings sind die Patientenzahlen für eine abschließende Beurteilung noch zu klein und die Ergebnisse einer vergleichenden Untersuchung verschiedener adjuvanter Behandlungsverfahren durch die European Study Group for Pancreatic Cancer steht noch aus. Die alleinige Bestrahlung des Operationssitus, die auch intraoperativ durchgeführt werden kann, führt zwar zu einer Senkung der Rate an Lokalrezidiven und hat einen positiven Effekt auf die Schmerzen der Patienten, verlängert aber nicht das Überleben und ist mit einer erheblichen Komplikationsrate (30%) wie Blutungen und Perforationen belastet.
Palliative Therapie
Da 70-90% der Pankreaskarzinompatienten im Laufe der Erkrankung einen Verschlußikterus und 25% eine Duodenalstenose entwickeln, kommen eine Reihe von palliativen chirurgischen Verfahren zum Einsatz, die das Leiden der Betroffenen erheblich lindern können. Die wichtigsten Operationen in diesem Zusammenhang sind die bilio-digestive Anostomose (meist als Choledocho-jejunostomie durchgeführt) und die Gastrojejunostomie. Als Alternative bei zu den chirurgischen Verfahren haben sich für die oft schwerkranken Patienten eine Reihe endoskopischer Methoden bewährt. So kann zum Beispiel die Duodenalstenose mittels Ernährungssonden ins Jejunum überbrückt werden, die für einen kurzen Zeitraum nasal, bei längerer Lebenserwartung als jejunaler Schenkel einer perkutanen endoskopischen Gastroenterostomie, oder sogar als transkutane, transhepatische Verweilsonde plaziert werden. Die tumorbedingte Stenose im Ductus choledochus oder an der Papille wird meist durch flexible Kunststoff- oder selbstexpandierende Metallstents suffizient überbrückt, und dies behebt über längere Zeiträume den Verschlußikterus. Gelingt eine endoskopische Plazierung aus technischen oder anatomischen Gründen (z.B. eine vorausgegangene Billroth II Operation des Magens oder ein Tumoreinbruch ins Duodenum) nicht, dann kann die Galle über eine perkutane transhepatische Choledochusdrainage nach außen abgeleitet, oder über eine Yamakawa-Prothese in den Dünndarm eingeleitet werden. Alle diese chirurgischen, endoskopischen und transkutanen Verfahren haben die Palliation der Beschwerden des Patienten zum Ziel - die Lebenserwartung dieser Tumorerkrankung beeinflußen sie nicht.
Palliative Chemotherapie
Alle palliativen Therapieansätze müssen berücksichtigen, daß Patienten mit nicht mehr operablen Pankreaskarzinom eine mittlere Lebenserwartung von 3-5 Monaten haben. Bei nicht mehr kurativem Ansatz verbieten sich deshalb alle Behandlungsansätze die mit schwerwiegenden Nebenwirkungen verbunden sind oder die verbleibende Lebensqualität erheblich beeinträchtigen. Da es bis heute keine Standardtherapie für das Pankreaskarzinom gibt, sollten alle Patienten, die chemo- oder strahlentherapeutisch behandelt werden, innerhalb von kontrollierten Studien therapiert werden. Zur sowohl zu externen als auch zur intraoperativen Strahlentherapie liegen verschieden Studien bis zu Strahlendosen von 60Gy vor. Beide Formen der Bestrahlung führen nicht zu einer signifikanten Lebensverlängerung. Wegen der mit der Strahlentherapie verbundenen Komplikationsrate von bis zu 30% kann diese Behandlung alleine heute nicht mehr empfohlen werden. Für die Monochemotherapie des Pankreaskarzinoms sind in der Vergangenheit mehr als 30 Einzelsubstanzen getestet worden. Keine hat die in sie gesetzten Erwartungen erfüllt und die konstant besten Ansprechraten von ca. 20% werden mit 5-Fluourazil erreicht. An sowohl diesem Therapieergebnis, als auch an der geringen Nebenwirkungsrate des 5-FU müssen sich inzwischen alle Kombinations- und Monochemotherapieansätze messen. Zumindest letzteres trifft für die Monotherapie mit Gemzitabin zu. Eine signifikante Lebensverlängerung läßt sich durch diese beiden Substanzen alleine nicht erreichen. Durch die Kombination des 5-FU entweder mit Leucovorin und Interferon alpha 2A, oder mit einer fraktionierten Bestrahlung ließ sich in verschiedenen Studien eine Lebensverlängerung auf ca. 10 Monate erreichen. Eine ganz Anzahl weiterer, zum Teil sehr kleiner Studien, die 5-FU mit anderen zytostatischen Substanzen kombiniert haben, liegt heute vor. Die maximal erreichbaren Überlebenszeiten unter diesen Kombinationen liegen zwischen 12 und 14 Monaten. Zum einen wegen der erheblichen Nebenwirkungen, zum anderen wegen des Fehlens randomisierter Studien haben sich diese Protokolle aber bisher nicht duchsetzen können. Zuletzt wurden sehr optimistische Ergebnisse aus einer Pilotstudie mit der Kombination des langwirksamen Somatostatin Analog Octreotid und dem Östrogen Rezeptor Antagonist Tamoxifen berichtet. Auch diese Studie erfaßt jedoch ein zu kleines Patientenkollektiv, um eine abschließende Beurteilung zu erlauben.
Schmerztherapie
Viele Patienten, die an einem Pankreaskarzinom erkrankt sind, leiden unter erheblichen abdominellen Schmerzen. Für die Stufentherapie nach dem Schema der WHO gilt grundsätzlich das im Abschnitt über die Schmerzen bei chronischer Pankreatitis Aufgeführte. Zunächst sollte mit peripher wirksamen Analgetika (Parazetamol, ASS, Metamizol), dann in einer Kombination mit zunächst schwachen (Tramadol), später stark wirksamen Opiatanalogen (Tabelle 6) behandelt werden. Sowohl die Einzelsubstanzen als auch die Kombinationen sollten nicht bei Bedarf sondern in festen Intervallen über den Tag verteilt eingenommen werden. Die Gefahr der Gewöhnung oder Schmerzmittelabhängigkeit muß bei der sehr limitierten Prognose der Erkrankung völlig ignoriert werden, und die Schmerzfreiheit des Patienten ist eines der wichtigsten Therapieziele. Bei vielen Patienten läßt sich eine langfristige Schmerzfreiheit durch Neurolyse des Plexus coeliacus (meist durch Instillation von fünfzigprozentigem Alkohol) erreichen. Diese kann entweder transkutan CT-gesteuert oder intraoperativ während eines, aus anderen Gründen durchgeführten, Palliativeingriffs erfolgen.
Weiterführende Allgemeinliteratur
Lerch M.M. und Schmid R. Klinik der akuten Pankreatitis. Acta Chir. Austr. 1995;27:186-189.
Layer P. und Lerch M.M. Akute Pankreatitis - Konservative Therapie. in: Winkeltau GJ. und Lerch M.M. (Hrsg) Gastroenterologische Notfalltherapie. Wissenschaftliche Verlagsgesellschaft 1996 pp109-117.
Mössner J. Chronische Pankreatitis - Diagnostik, Therapie und Langzeitergebnisse. Therapiewoche 1996;26:1452-1460.
Baer H.U., Wagner M, Sadowski C, Büchler M.W. Pankreaskarzinom - Chirurgische Therapie. Therapeutische Umschau 1996;53:394-400.
Schmall S.F. und MacDonald J.S. Chemotherapy of adenocarcinoma of the pancreas. Semin. Oncol. 1996;23:220-228.
Tabelle: Relative Häufiggkeit von Neubildungen des exokrinen Pankreas
Benigne Neubildungen
* seröses Zystadenome 1%
Maligne Neubildungen
* duktale Adenokarzinome 92%
* muzinös-zystische Tumoren 2%
* Azinuszellkarzinome 1%
* alle übrigen 4%
Tabelle: klinische Erstsymptome des Pankreaskarzinoms
nach Howard und Jordan 1977
Tumor im Pankreaskopf Tumor in Corpus und Schwanz
Gewichtsverlust 92% 100%
Ikterus 82% 7%
Abdominalschmerz 72% 87%
Inappetenz 64% 33%
Übelkeit 45% 43%
Erbrechen 37% 37%
Schwäche 35% 43%
Tabelle: Lebenserwartung bei verschiedenen malignen Pankreastumoren
Nach 1 Jahr Nach 5 Jahren
* duktales Adenokarzinom 17% 1%
* Riesenzellkarzinom 0% 0%
* Adenosqamöses Karzinom 5% 0%
* Mikroadenokarzinom 0% 0%
* Azinuszellkarzinom 14% 0%
* Muzinöses Adenokarzinom 33% 0%
* Muzinöses Zystadenokarzinom 100% 40-80%
Tabelle: TNM-Klassifikation des Pankreaskarzinoms
T1 Tumor ist auf das Pankreas beschränkt
T2 Organübergreifender Tumor mit Beteiligung von Duodenum,
Gallenwegen oder Magen
T3 Fortgeschrittene, nicht mehr resezierbare lokale Ausbreitung
N0 Ohne Beteiligung regionaler Lymphknoten
N1 Mit Beteiligung regionaler Lymphknoten
M0 Ohne Fernmetastasen
M1 Mit Fernmetastasen
Autor:
Prof. Dr. med. Markus M. Lerch
Klinik und Poliklinik für Innere Medizin A
Universitätsmedizin Greifswald
Ferdinand-Sauerbruch-Str.
D-17475 Greifswald
Telefon: +49 (0)3834 86-7230
Fax: +49 (0)3834 86-7234
E-Mail: gastro@uni-greifswald.de